Evenwichten en omkeerbare reacties
Sommige reacties bereiken nooit 100% rendement omdat ze omkeerbaar zijn. De reactieproducten reageren terug naar de beginstoffen, wat je aangeeft met een dubbele pijl (⇌) in de reactievergelijking.
Bij een evenwichtsreactie verlopen de heen- en teruggaande reactie tegelijkertijd met dezelfde snelheid. Dit heet een dynamisch evenwicht - er gebeurt nog steeds van alles, maar de concentraties blijven constant.
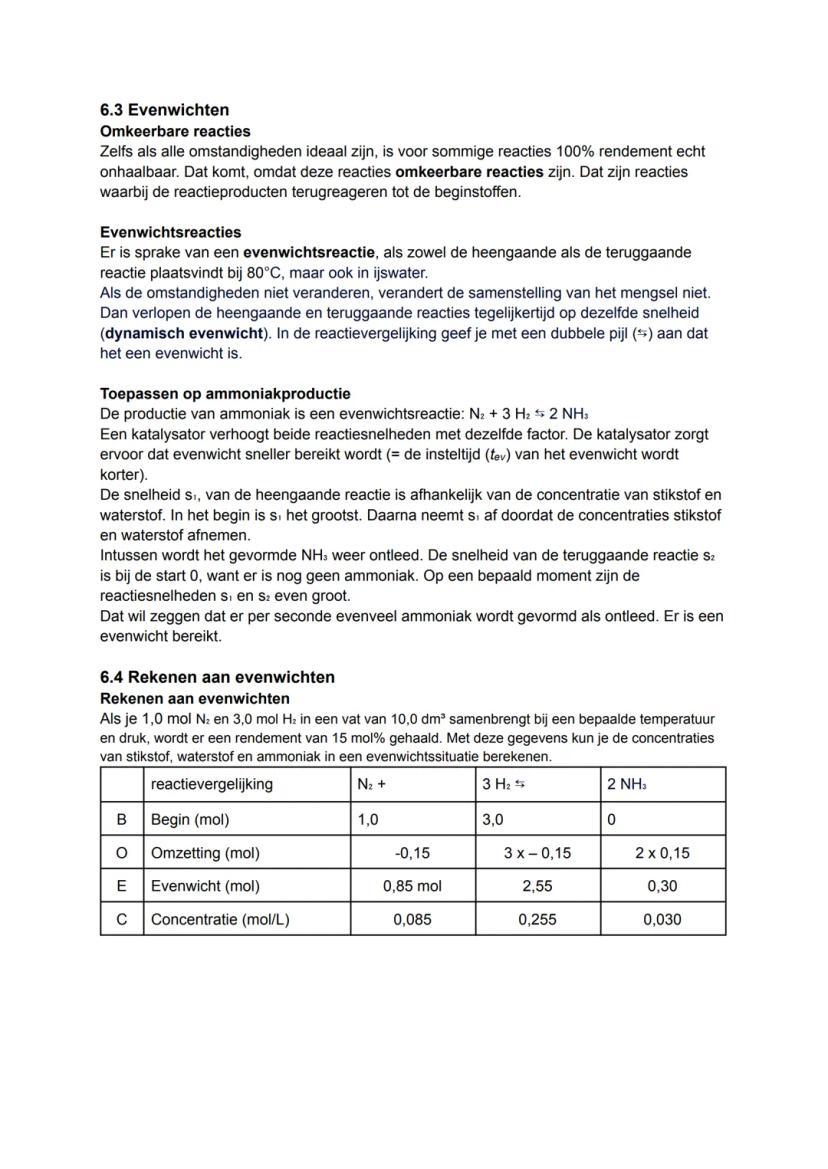
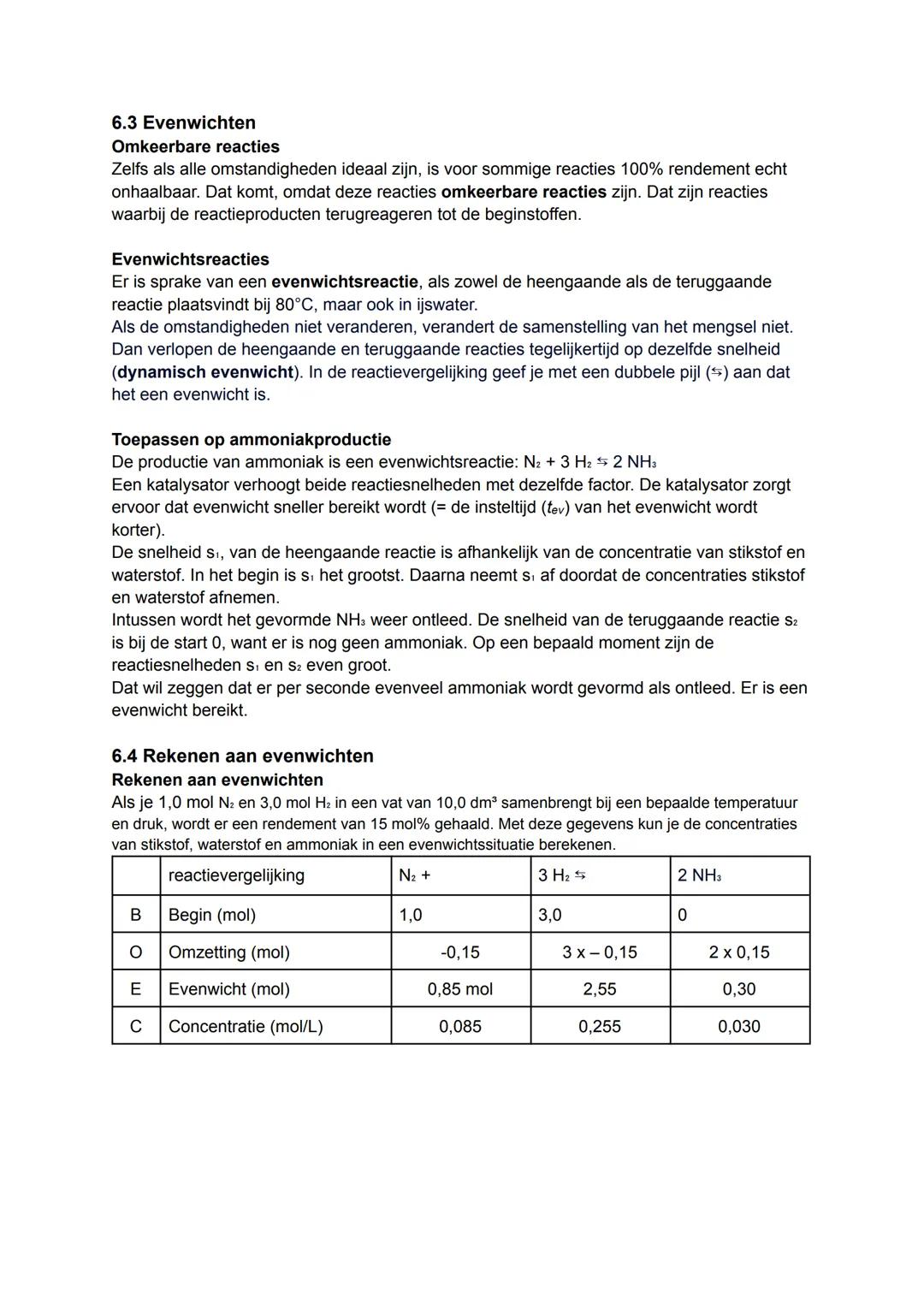
De ammoniakproductie N2+3H2⇌2NH3 is een perfect voorbeeld. In het begin is de heengaande reactie (s1) het snelst omdat er veel N₂ en H₂ aanwezig is. Naarmate er meer NH₃ wordt gevormd, neemt de teruggaande reactie (s2) toe.
Een katalysator versnelt beide reactierichtingen evenveel, waardoor het evenwicht sneller wordt bereikt maar de uiteindelijke verhoudingen hetzelfde blijven.
Belangrijk: In evenwicht betekent niet dat alles stilstaat - beide reacties gaan door, maar ze heffen elkaar precies op.